UDI – Anforderungen an Medizinprodukte und In-vitro-Diagnostika
Ein Gemeinschaftsseminar mit der DIN-Akademie. Berlin
http://www.beuth.de/de/seminar/udi-anforderungen-an-medizinprodukte-und-in-vitro-diagnostika/271142095
*UDI++ nützt der Klinik
Wie die 2017 anstehende EU-Initiative zu mehr Patientensicherheit, umfassenden Stammdaten und Kosteneinsparungen verhelfen kann.
weiterlesen unter: healthcaretag.de
Nach dem Termin 24. September 2016 für die Registrierung der Medizinprodukte der US-Klasse II in der „Global UDI Data Base – GUDID geht es entsprechend dem Plan der FDA in die Phase für die letzte Gruppe der Klasse I.
Die neue EU Verordnung für Medizinprodukte "Medical Device Regulation (MDR)" ist nun ebenso mit Teil "UDI" öffentlich.
Zur Information über die UDI-Implementierungsschritte entsprechend der Kennzeichnungs- und Registrierpflichten für UDI in USA und Europa und wie Hersteller UDI managen, können Sie sich bei 3 Veranstaltungsterminen anmelden:
| Termin | Gastgeber | Veranstaltungsinformation | Anmeldung | Programm |
| 17. Mai 2017 | Med+Logistica, LeipzigMed | healthcaretag.de | Danke für ihre Teilnahme! | |
| Archiv | ||||
| 24.November 2016 | Hilton Metropole, London, UK | Danke für ihre Teilnahme! | ||
| 29. November 2016 | Medical-Mountains AG Tuttlingen | Danke für ihre Teilnahme! | ||
| 26.September 2016 | IHK Darmstadt | Danke für ihre Teilnahme! Resourcen sind online |
||
| 28. September 2016 | Medical-Valley Erlangen |
Danke für ihre Teilnahme! |
||
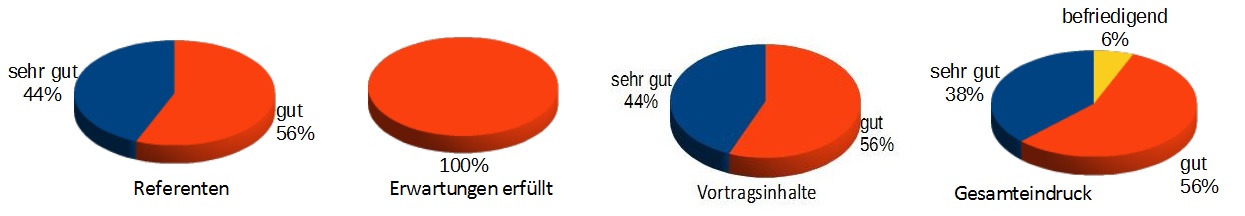 Dies sind die Ergebnisse der Teilnehmnerbefragung in Erlangen. Dies sind die Ergebnisse der Teilnehmnerbefragung in Erlangen. |
||||